Dieser Fachartikel zeigt eine Absetzmethode, mit der sich Entzugssymptome bei den »SSRI-Antidepressiva« Citalopram, Escitalopram, Paroxetin, Fluoxetin und Sertralin vermeiden oder zumindest so gering wie möglich halten lassen. Die offiziellen Absetzsmodelle der Psychiatrie sind nicht zu empfehlen. Der Beitrag enthält die vollständige Übersetzung des Fachartikels Tapering of SSRI treatment to mitigate withdrawal symptoms von Dr. Horowitz und Prof. Dr. Taylor. Ich hatte Dr. Horowitz angeschrieben und gebeten den Fachbeitrag zu übersetzen und hier veröffentlichen zu dürfen, was dieser mit Freude erlaubte.
UPDATE:
Dr. Mark Abie Horowitz und David Taylor haben am 15. Februar 2024 das Buch »The Maudsley Deprescribing Guidelines: Antidepressants, Benzodiazepines, Gabapentinoids and Z-drugs (The Maudsley Prescribing Guidelines Series)« veröffentlicht. Das Buch ist bei amazon.de erhältlich.
The Maudsley Deprescribing Guidelines (The Maudsley Prescribing Guidelines Series)
Beschreibung: Die »Maudsley-Leitlinien« zum richtigen Reduzieren und Absetzen von Antidepressiva, Benzodiazepinen, Gabapentinoiden und Z-Drugs
Umfassende Ressource mit Leitlinien für die sichere Reduzierung oder das Absetzen (Deprescribing) von Antidepressiva, Benzodiazepinen, Gabapentinoiden und Z-Medikamenten für Patienten, einschließlich schrittweiser Anleitungen für alle häufig verwendeten Medikamente, die häufige Fallstricke, Fehlerbehebung, unterstützende Strategien und mehr umfassen.
Die meisten formellen Anleitungen zur psychiatrischen Medikation beziehen sich auf den Beginn oder die Umstellung von Medikamenten und enthalten nur wenige Hinweise zur Absetzung von Medikamenten. Im Jahr 2023 forderten die Weltgesundheitsorganisation und die Vereinten Nationen, dass Patienten als Menschenrecht über ihr Recht, die Behandlung abzubrechen, informiert werden und dabei Unterstützung erhalten sollten.
Die» Maudsley Deprescribing Guidelines« schließen eine bedeutende Lücke in den Leitlinien für Kliniker, indem sie umfassende und maßgebliche Informationen zu diesem wichtigen Aspekt der Behandlung liefern.
Dieses evidenzbasierte Handbuch bietet einen Überblick über die Grundsätze, die bei der Verschreibung von Medikamenten zu beachten sind.
Es stützt sich auf wissenschaftliche Grundprinzipien und die neuesten Forschungsergebnisse zu diesem Thema, kombiniert mit neuen Erkenntnissen aus der klinischen Praxis (auch von Patientenexperten).
Aufbauend auf der anerkannten Fachliteratur der »Maudsley-Verschreibungsrichtlinien« und der Bekanntheit der Autoren, die u. a. in »The Lancet Psychiatry« über das Absetzen von Antidepressiva berichtet haben (der meistgelesene Artikel in allen Lancet-Titeln, als er veröffentlicht wurde). Die» Maudsley Deprescribing Guidelines« behandeln Themen wie:
- Warum und wann Antidepressiva, Benzodiazepine, Gabapentinoide und Z-Medikamente abgesetzt werden sollen
- Hindernisse und Erleichterungen beim Absetzen von Medikamenten, einschließlich körperlicher Abhängigkeit, sozialer Umstände und Wissen über den Absetzprozess
- Unterscheidung von Entzugssymptomen wie schlechter Stimmung, Angst, Schlaflosigkeit und einer Vielzahl von körperlichen Symptomen von den Symptomen der zugrunde liegenden Erkrankung, die mit dem Medikament behandelt werden sollte
- Der Unterschied zwischen körperlicher Abhängigkeit und Sucht/Stoffwechselstörung
- Erläuterung, warum und wie die »hyperbolische Absetzmethode« in der klinischen Praxis umgesetzt werden kann
- Spezifische Anleitungen zu Medikamentenformulierungen und Techniken für eine schrittweise Reduzierung, einschließlich der Verwendung von flüssigen Medikamenten und anderen Ansätzen
- Schritt-für-Schritt-Anleitung für das sichere Absetzen aller häufig verwendeten Antidepressiva, Benzodiazepine, Gabapentinoide und Z-Drogen, einschließlich schneller, moderater und langsamer Reduzierungsschemata oder -zeitpläne für jedes Medikament und Anleitungen, wie diese individuell angepasst werden können
- Probleme, die beim Absetzen dieser Medikamente auftreten können, wie Akathisie, akute oder langwierige Entzugssymptome und Rückfälle.
Übersetzt mit DeepL.com (kostenlose Version)
Quelle: https://www.amazon.de/Maudsley-Guidelines-prescribing-David-Taylor/dp/111982298X
»Absetzmethode zur Verminderung von Entzugssymptomen beim Reduzieren und Absetzen von SSRI-Antidepressiva«
von Mark Abie Horowitz, David Taylor
Lancet Psychiatry 2019; 6: 538–46
Online publiziert 05. März 2019
https://dx.doi.org/10.1016/S2215-0366(19)30032-X
»Prince of Wales Hospital«, Sydney, NSW, Australia
(M A Horowitz PhD); »Health and Environment Action Lab«, London, UK (M A Horowitz); and »Institute of Pharmaceutical Science«, »King’s College London«, London, UK (Prof D Taylor PhD)
Korrespondenz an:
Dr Mark Abie Horowitz, »Prince of Wales Hospital«, Sydney, NSW 2031, Australia
mark_horo[at]hotmail.com
Deutsche Übersetzung:
Markus Hüfner und Marijana Babic.
Kontakt Übersetzer:
E-Mail: webautor@die-psychopharmaka-falle.de
Web: https://die-psychopharmaka-falle.de
Rechtlicher Hinweis:
Der vorliegende Fachartikel wurde mit der ausdrücklichen Erlaubnis von Dr. Horowitz möglichst wortgetreu aus dem Englischen übersetzt. Eine etwaige Haftung wird nicht übernommen, die Übersetzung dient lediglich der Information. Einige Fachbegriffe wurden dabei in den Tooltips, die im Ursprungstext nicht vorhanden sind, zur besseren Verständlichkeit erläutert oder in Klammern mit dem Vermerk Anmerkung des Übersetzers, kurz Anm. d. Ü.. Wer sich tiefer in die Materie einarbeiten will, kann den Originaltext mit der dort zitierten Literatur heranziehen. Dieser ist über »The Lancet Psychiatry« kostenpflichtig für 30 $ einmalig erwerbbar:
https://www.thelancet.com/journals/lanpsy/article/PIIS2215-0366(19)30032-X/fulltext
Der Originalartikel, die darin enthaltenen Grafiken und Tabellen sowie die vollständige deutsche Übersetzung unterliegen dem Urheberrecht und dürfen nicht publiziert werden, es sei denn der Autor des Originalartikels erlaubt dies. Die Weitergabe zum Zweck der Information an behandelnde Ärzte und Patienten ist erlaubt und erwünscht.
Download als PDF-Dokument zur Weitergabe an Ärzte und Patienten:
Ich habe den Beitrag als PDF-Dokument gespeichert und diesem Hinweise für den Arztbesuch, für Patienten und rechtliche Hinweise vorangestellt.
Im Anhang findest Du konkrete Absetzschemata für die einzelnen SSRI-Antidepressiva sowie die im Fachartikel erwähnte »Discontinuation Emergent Signs and Symptoms Checklist (DESS)« – Checkliste von beim Entzug auftretender Anzeichen und Symptome. Anhand dieser Checkliste kannst Du überprüfen, ob nach einer Reduzierung des SSRI ein neues Entzugssymptom dazu gekommen ist, ein bestehendes (altes) Symptom sich verschlechtert oder verbessert hat, bzw. unverändert geblieben ist oder ein Symptom nicht (mehr) vorhanden ist:
Einen empfehlenswerten Beitrag über die Arbeit von Dr. Horowitz hat der von mir wertgeschätzte Arzt Dr. Peter Ansari auf seinem Infoportal »depression-heute.de« publiziert:
Zusammenfassung
Alle Klassen von Medikamenten, die zur Behandlung von Depressionen verschrieben werden, werden mit Entzugssyndromen assoziiert. Das »SSRI-Absetzsyndrom« tritt häufig auf und kann schwerwiegend sein, so dass Patienten gezwungen sein können, ihre Medikation wiederaufzunehmen.
Obwohl das Absetzsyndrom von einem Wiederauftreten der zugrunde liegenden Störung unterschieden werden kann, kann es auch mit einem Wiederauftreten der Störungssymptome verwechselt werden, was (wiederum) zu einer langfristigen unnötigen Medikamenteneinnahme führen kann.
(Psychiatrische) Leitlinien empfehlen einen kurzen Absetzprozess von 2 bis 4 Wochen bis auf die therapeutische Minimaldosis (die im Beipackzettel empfohlene Minimaldosis, Anm. d. Ü.) oder die halbe Minimaldosis, bevor das Medikament vollständig abgesetzt wird. Studien haben gezeigt, dass diese Reduzierungsprozesse nur minimale Vorteile gegenüber einem abrupten Absetzen haben und von den Patienten oft nicht toleriert werden. Ein Absetzen über mehrere Monate bis hin zu Dosen, die deutlich unter der therapeutischen Minimaldosis liegen, hat einen größeren Erfolg bei der Reduzierung der Entzugssymptome gezeigt.
Andere Typen von Medikamenten, die mit Entzugssymptomen assoziiert werden, etwa Benzodiazepine, werden schrittweise abgesetzt, um deren biologischen Effekt auf die Rezeptoren durch festgelegte Mengen zu reduzieren und damit Entzugssymptome abzuschwächen. Diese Dosisreduktionen werden mit exponentiell basierten Absetzprogrammen durchgeführt, die sehr kleine Dosen erzielen. Diese Methode könnte für das Absetzen von SSRIs von Bedeutung sein.
Wir untersuchten die PET-Bildgebungsdaten (PET = Positronen-Emissions-Tomographie, Amn. d. Ü.) der Serotonin-Botenstoff-Besetzung durch SSRIs und fanden heraus, dass eine hyperbolische Dosisreduktion von SSRIs deren Effekt auf die Serotonin-Botenstoff-Hemmung in linearer Weise reduziert.
Wir schlagen daher vor, dass SSRIs hyperbolisch und langsam auf Dosen reduziert werden sollten, die weit unter den therapeutischen Minimaldosen liegen, in Übereinstimmung mit den Absetzschemata für andere Medikamente, die mit Entzugssymptomen assoziiert werden. Die Entzugssymptome werden dann verringert.
Einführung
Viele Medikamente werden mit Entzugssyndromen assoziiert, am häufigsten diejenigen, die auf das kardiovaskuläre System (Herz-Kreislauf-System, Anm. d. Ü.) und das Zentrale Nervensystem wirken.[1] Alle wichtigen Klassen von Antidepressiva – Monoaminoxidase-Hemmer (MAO-Hemmer), trizyklische Antidepressiva, SSRIs (Selektive-Serotonin-Wiederaufnahmehemmer) und SNRIs (Selektive Serotonin-Noradrenalin-Wiederaufnahmehemmer) werden mit Entzugssymptomen beim Absetzen assoziiert.[2],[3] Der Begriff »Absetzsyndrom« wurde geprägt, um das (spezifische) Entzugssyndrom im Zusammenhang mit Antidepressiva zu beschreiben.[4] Das SSRI-Absetzsyndrom, wie es im DSM-5 (Diagnostic and Statistical Manual of Mental Disorders – Diagnostisches und statistisches Handbuch der psychischen Störungen) beschrieben[5] und in der Checkliste Discontinuation Emergent Signs and Symptoms (DESS, siehe Anhang 1)- Checkliste von beim Entzug auftretender Anzeichen und Symptome[6] erfasst ist, beinhaltet eine Vielzahl von somatischen (körperlichen) und psychischen Symptomen (Abbildung 1).
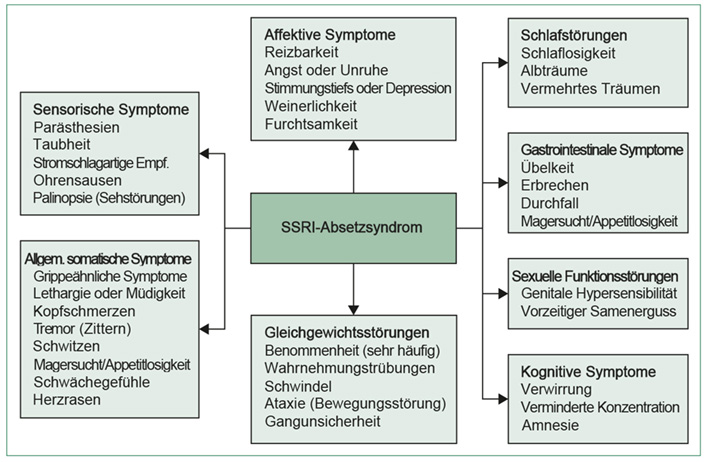
Abbildung 1: Symptome des SSRI-Absetzsyndroms
SSRI-Entzugssymptome können, teilweise, den Symptomen von Angstzuständen oder Depressionen ähneln, gegen die das Medikament ursprünglich verabreicht wurde.[5]
Das Absetzsyndrom kann jedoch von einem Rückfall oder einem Wiederauftreten der zugrunde liegenden Störung unterschieden werden, da es schnell auftritt (eher innerhalb von Tagen als von Wochen),[3],[7],[8] schnell auf die Wiedereinnahme des SSRI anspricht (im Allgemeinen innerhalb von Stunden, sicherlich innerhalb von Tagen),[3],[7],[9] und somatische und psychologische Symptome aufweist, die sich von der ursprünglichen Erkrankung unterscheiden (einschließlich Schwindel, Übelkeit und stromschlagartigen Empfindungen).[7],[10] Das Absetzsyndrom kann als depressives Rezidiv (Rückkehr der Depression, Anm. d. Ü.) fehldiagnostiziert werden, was zu einer anhaltenden Behandlung von Patienten führt, die diese möglicherweise nicht benötigen;[11-13] allerdings ist nicht gesichert, wie häufig dies auftritt.[14]
SSRI-Entzugssymptome treten bei vielen Patienten auf, wobei die berichtete Häufigkeit von 42 % bis 100 % für Paroxetin,[6],[15-18] und von 9 % bis 77 % für Fluoxetin,[6],[15],[17],[18] mit einer mittleren Rate von 53,6 % für SSRIs in 14 Studien, die den Antidepressiva-Entzug untersucht haben, variiert.[13] Die Häufigkeit und der Schweregrad scheinen von der Halbwertszeit und den Rezeptoraffinitäten (Fähigkeit eines Medikamentes, sich durch Komplexbildung an einen Rezeptor zu binden, hier Serotoninrezeptoren bzw. bei SNRI zusätzlich Noradrenalin-Rezeptoren; s. Pschyrembel, Anm. d. Ü.), der Behandlungsdauer und -dosis, der Absetzmethode und individuellen Patientencharakteristika, möglicherweise einschließlich Antizipationseffekten (Erwartung und Erwartungshaltung des Patienten bzgl. der Behandlung, Anm. d. Ü.), beeinflusst zu werden.[3],[9],[19] Eine systematische Übersichtsarbeit identifizierte fünf Studien, die den Schweregrad von Entzugseffekten untersuchten, und berichtete, dass fast die Hälfte der Teilnehmer, die Entzugseffekte erlebt hatten, die äußerste Möglichkeit auf der Skala wählten, die ihnen zur Beschreibung des Schweregrads dieser Effekte zur Verfügung stand.[13]
Die Absetzphase (14 Tage nach dem Absetzen) ist außerdem mit einem 60 %- Anstieg der Suizidversuche im Vergleich zu bisherigen Nutzern von Antidepressiva assoziiert (das erhöhte Suizidrisiko wird daher dem Entzugsprozess und nicht der Nicht-Behandlung der Depression zugeschrieben).[20]
Das SSRI-Absetzsyndrom kann wesentlich länger dauern als 1-2 Wochen[13], wie bisher angenommen.[4] In einer Studie dauerten die Entzugssymptome im Allgemeinen bis zu 6 Wochen, wobei ein Viertel der Patienten über Symptome berichtete, die länger als 12 Wochen andauerten.[18] Eine andere Studie gibt an, dass das Absetzsyndrom bei 86,7 % der Befragten mindestens 2 Monate, bei 58,6 % mindestens 1 Jahr und bei 16,2 % mehr als 3 Jahre gedauert hatte.[21] In Fallberichten werden Symptome beschrieben, die ein Jahr oder länger dauern.[22],[23]
Die zunehmend langfristige Einnahme von SSRIs (fast die Hälfte der Patienten in Großbritannien, die Antidepressiva einnehmen, tun dies länger als zwei Jahre)[19],[24] ist zum Teil darauf zurückzuführen, dass Patienten aufgrund der abschreckenden Natur des Absetzsyndroms nicht bereit sind, die Medikation zu beenden,[19],[25] und dass es nur wenige Informationen darüber gibt, wie man das Absetzsyndrom abmildern kann.[19],[25] Ärzte beklagen, dass nicht ausreichend Anleitung existiert, wie man beim Absetzen vorgehen sollte.[19]
SSRIs absetzen
Leitlinien empfehlen ein kurzfristiges Absetzen von SSRIs anstelle eines abrupten Absetzens, um Entzugssymptome zu vermeiden. Das »National Institute for Health and Care Excellence«,[26] die »British Association for Psychopharmacology«,[12] das »Monthly Index of Medical Specialities«[27] sowie »UpToDate«[28] empfehlen das Absetzen in einem Zeitraum von 2 bis 4 Wochen mit einer linearen Dosisreduktion bis zur minimalen therapeutischen Dosis bzw. der Hälfte der minimalen therapeutischen Dosis, vor dem vollständigen Absetzen. Diese Leitlinien legen nahe, dass Fluoxetin nicht reduziert werden muss,[28] oder dass Fluoxetin bei hohen Dosen über einen Zeitraum von 2 Wochen reduziert werden kann.[27] Die Empfehlungen der Arzneimittelhersteller wurden in einer systematischen Überprüfung als genauso vage und unspezifisch
eingestuft.[29]
In randomisierten Studien zeigte ein Absetzen über einen Zeitraum von bis zu 14 Tagen entweder keine[16] oder nur eine minimale[30] Abnahme der Schwere der Entzugssymptome im Vergleich zum abrupten Absetzen.[31] Aus diesen Studien wurde allgemein gefolgert, dass längere Reduzierungsmodelle erforderlich sind.[3],[32] Tatsächlich zeigten Studien, in denen über einen Zeitraum von mehreren Monaten reduziert wurde[33-35], bessere Ergebnisse (Tabelle 1). In einer Studie senkte eine Reduktion von Paroxetin um 10 mg alle 2 Wochen die Entzugshäufigkeit von 33,8 % auf 4.6 %.[33] Wenn die Patienten, die in dieser Studie Entzugssymptome hatten, wieder mit der Medikation begannen und dann alle 2-4 Wochen um 5 mg reduzierten, konnten Entzugssymptome erfolgreich vermieden werden.[33] In einer anderen Studie traten bei Patienten, die ihre SSRI-Dosis über einen Zeitraum von bis zu 4 Monaten reduzierten, 5,1 Absetzerscheinungen und -symptome auf, verglichen mit 11,7 Absetzerscheinungen und -symptomen bei Patienten, die abrupt absetzten.[34]
In einer anderen Studie mit Paroxetin traten bei Patienten, die ihre Dosis über eine durchschnittliche Dauer von 38,6 Wochen (Bereich von 2-197 Wochen), abgestimmt auf die jeweilige Person, reduzierten, bei 6,1 % Entzugssyndrome auf, verglichen mit 78,2 % bei abruptem Absetzen (Tabelle 1).[35] Absetzstreifen für Antidepressiva (sogenannte Tapering-Strips, Anm. d. Ü.), bei denen die Medikation auf kleine Mengen der minimalen therapeutischen Dosis reduziert wird (z. B. 0,5 mg für Paroxetin und Citalopram), haben vorteilhafte Ergebnisse gezeigt; 71 % von 895 Patienten, von denen 97 % zuvor einen Entzug erlebt hatten, waren in der Lage, ihre Medikation über einen Zeitraum von durchschnittlich 56 Tagen (IQR 28-84 Tage) abzusetzen.[14] Mehrere Fallstudien stützen ebenfalls die Theorie einer besseren Wirksamkeit eines langsameren Absetzens.[36-38] In einem aufschlussreichen Fall war eine mehrmonatige Reduktion auf eine durchschnittliche Dosis von 6,25 mg Sertralin pro Tag erforderlich, um Entzugssymptome bei einem Mann zu vermeiden, dessen entzugsbedingte orthostatische Hypotonie eine objektive Messung erlaubte.[36]
Zwei Studien aus dem Jahr 2018 bestätigen, dass kürzere Reduktions-Modelle, wie sie in den Leitlinien empfohlen werden, nicht effektiv sind. Eine Studie fand heraus, dass eine Reduktion über 4 Wochen nicht durchführbar war, wobei 60 % der Patienten (51 von 85) ihre Medikamente über 4 Monate reduzierten.[39] Eine andere Studie, die weitgehend lineare Reduzierungen mit finalen Dosen in Höhe der therapeutischen Mindestdosis (oder der Hälfte dieses Wertes) verwendete, fand heraus, dass nur 37 % der Patienten (26 von 71) in der Lage waren, ihre Medikamente abzusetzen.[40] Eine große Studie mit 400 Patienten zeigte ein signifikant geringeres Rückfallrisiko, wenn die Antidepressiva schrittweise (>14 Tage) statt schnell (1-7 Tage) abgesetzt wurden.[41]
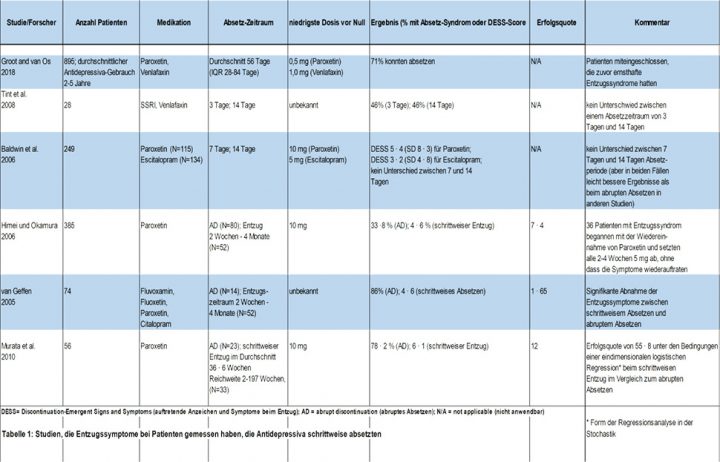
Tabelle 1: Studien, bei denen Entzugssymptome bei Patienten gemessen wurden, die Antidepressiva abgesetzt haben
DESS = Discontinuation Emergent Signs and Symptoms (auftretende Anzeichen und Symptome beim Entzug), AD = abruptes Absetzen, N/A = nicht anwendbar
zum Vergrößern auf das Bild klicken.
Neurobiologie des Entzugs und dessen Handhabung
Das Konzept des Absetzens/Ausschleichens von SSRIs basiert auf der Überlegung, dass biologische Systeme auf diese Weise mehr Zeit haben, sich an die Verringerung des verfügbaren Liganden (Liganden: in der Biochemie Moleküle oder Ionen, die reversibel und nichtkovalent mit einem zellulären Rezeptor interagieren, der dadurch aktiviert [Agonist] oder inaktiviert [Antagonist] wird, um Informationen an die Zelle weiter zu geben; s. Pschyrembel, Anm. d. Ü.) anzupassen, wodurch die Intensität der Entzugssymptome verringert wird.[3],[12],[32],[42] Rezeptoren, die durch ein Medikament aktiviert werden, werden oft herunterreguliert oder weisen eine reduzierte Empfindlichkeit auf, um die Homöostase aufrechtzuerhalten.[43] Ein abruptes Absetzen des Medikaments stört das homöostatische Gleichgewicht, was zu einer verminderten Stimulation führt, die als Entzugssymptome erlebt werden und die oft entgegengesetzt zur ursprünglichen Wirkung des Medikaments sind.[43] Zum Beispiel ist das Entzugssyndrom von trizyklischen Antidepressiva, die eine starke anticholinerge (als anticholinerg bezeichnet man in der Medizin Wirkungen, die sich aus der Hemmung des Neurotransmitters Acetylcholin ergeben, Anm. d. Ü.) Wirkung haben, durch cholinerge Effekte (z.B. Unruhe, Erregung, Angst, Halluzinationen, Krämpfe, Atemdepression, Bewusstseinsstörung, Mundtrockenheit, Verstopfung, Herzrasen, Anm.. d. Ü.) gekennzeichnet.[44] Eine Anpassung an die Medikation ist bei langfristiger und hoch dosierter Einnahme wahrscheinlicher.[45],[46] Medikamente mit kürzerer Halbwertszeit erzeugen Entzugssymptome mit größerer Häufigkeit, höherem Schweregrad und schnellerem Einsetzen als Medikamente mit längerer Halbwertszeit, wahrscheinlich, weil ihr Entzug mit einer schnelleren Abnahme der verfügbaren Liganden-Menge in Verbindung steht.[45],[47],[48] Entzugssymptome können in der Regel durch die Wiedereinführung des abgesetzten Wirkstoffs beseitigt werden, wodurch das System wieder in ein homöostatisches Gleichgewicht zurückkehrt.[43]
Der Hauptansatz zur Abschwächung der Entzugssymptome besteht darin, die Geschwindigkeit, mit der dieses Gleichgewicht gestört wird, zu reduzieren, um dem System Zeit für die Anpassung an die gesunkenen Liganden-Spiegel zu geben und so die Entzugssymptome auf ein erträgliches Maß zu begrenzen.[45] Dieser Prozess wird entweder durch die Substitution (Ersetzen, Anm. d. Ü.) eines länger wirkenden Medikaments vor dem Absetzen/Reduzieren oder durch das langsame Reduzieren eines Medikaments mit kurzer Halbwertszeit erreicht.[45],[48]
Bemerkenswert ist, dass eine Verringerung der Medikation um konstante Mengen (lineares Absetzen) im Laufe der Zeit zu immer schwereren Nebenwirkungen führt.[45],[48],[49] Dieser Effekt ist wahrscheinlich eine Folge des hyperbolischen Dosis-Wirkungs-Verhältnisses zwischen einem Medikament und einem Rezeptor, die dem Gesetz der Massenwirkung folgt,[50] wie es für die Wirkung von Diazepam auf seinen Zielrezeptor, γ-Aminobuttersäure A (GABA-A, Abbildung 2A), typisch ist. Folglich lauten die Absetzempfehlungen für Benzodiazepine, immer kleinere Dosisreduktionen vorzunehmen, während man sich dem Nullpunkt nähert;[45],[48],[49] »stop slow as you go low« (umso langsamer reduzieren, je niedriger die Dosis ist).[1]
Die Entwöhnungsrichtlinien für Benzodiazepine empfehlen eine Dosisreduktion, die proportional zur aktuellen Dosis ist (meist eine 10 %ige Reduktion), was zu exponentiell abnehmenden Modellen führt, im Gegensatz zu einer linearen Reduktion.[45],[49],[52] Zum Beispiel würde ein Absetzen von 20 mg Diazepam mit einer Rate von 10 % pro Woche eine Reduktion von 2 mg in der ersten Woche bedeuten. In der zweiten Woche würde die kumulative Reduktion 3,8 mg betragen (eine weitere Reduktion um 1,8 mg), in der dritten Woche 5,42 mg (eine weitere Reduktion um 1,62 mg), und so weiter (Abbildung 2B).
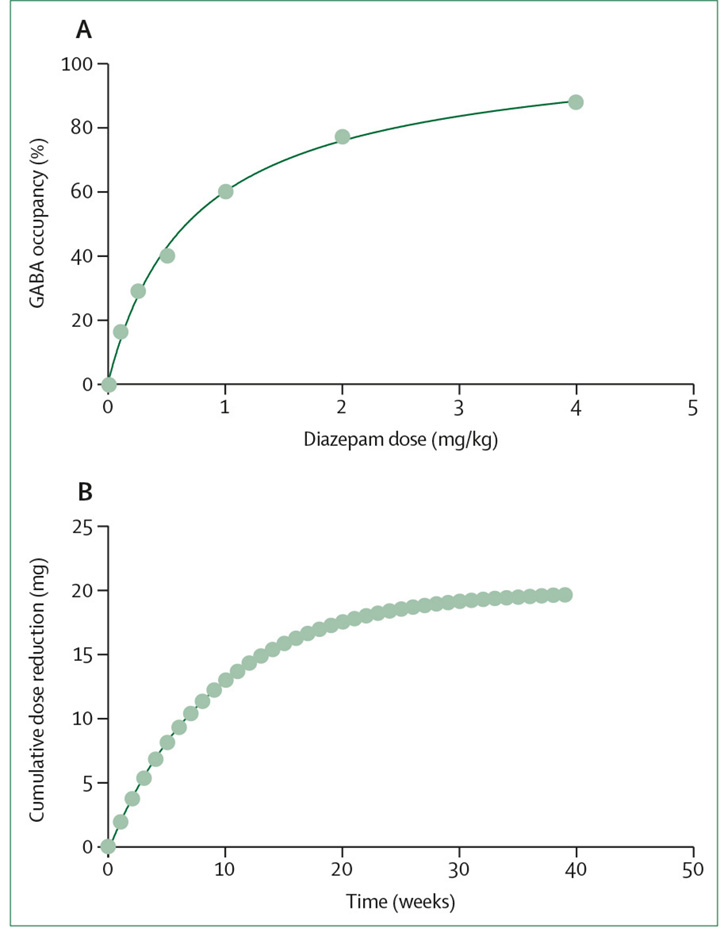
Abbildung 2: Abbildung 2: Empfohlenes Absetzschema für Diazepam basierend auf dessen Dosis-Wirkungs-Verhältnis
(A) Verhältnis zwischen Diazepam-Dosis und Wirkung an GABA-A-Rezeptoren bei nicht-menschlichen Primaten. Adaptiert von Brouillet und Kollegen.[51]
(B) Reduktion der Diazepam-Dosis, empfohlen in den Absetz-Richtlinien für 20 mg Diazepam (10 % Dosisreduktion pro Woche).[45],[49]
GABA = y-Aminobuttersäure.
Diese exponentiell abnehmenden Modelle führen zu einer annähernd linearen Reduktion der Wirkung am Zielrezeptor. Die Reduktionen werden bis zu Dosen fortgesetzt, die weit unter der minimalen therapeutischen Dosis liegen (die winzig erscheinen mag), bevor sie vollständig abgesetzt werden. Dieser Prozess wird durchgeführt, um einen Abfall in der Wirkung am Zielrezeptor zu vermeiden, der wesentlich größer ist als die Größe der zuvor tolerierten Schritte. Zum Beispiel beträgt die von den Entwöhnungsrichtlinien empfohlene finale Dosis von Diazepam 1 mg[45] (entspricht einer 4 %igen GABA-A-Rezeptor-Besetzung).[52]
Da man annimmt, dass die Entzugssymptome aufgrund homöostatischer Anpassungen an die reduzierten Medikamentenspiegel abklingen, wird eine Pause zwischen den Dosisreduktionen empfohlen.[45],[48],[49] Aufgrund der Tatsache, dass der genaue Zeitpunkt dieser Anpassungen nicht vollständig bekannt ist, wurden die meisten Leitlinien für den Entzug auf der Grundlage klinischer Erfahrungen entwickelt; ein Konsens schlägt vor, zwischen den Dosisreduktionen 1-4 Wochen zu warten, damit die Entzugssymptome abklingen können.[45],[48] Die meisten Leitlinien empfehlen, diesen Prozess zu individualisieren, da die Anpassung an die veränderten Medikamentenspiegel und die daraus resultierende Schwere und Dauer der Entzugssymptome variieren.[45],[48]
Pharmakologische Eigenschaften des SSRI-Entzuges
Das Entzugs- oder Absetzsyndrom von SSRIs hat die gleichen Ursachen wie eben beschrieben. Entzugssymptome treten häufiger auf, wenn SSRIs in hohen Dosen[53],[54] oder über lange Zeiträume gegeben werden.[53] Medikamente mit kürzerer Halbwertszeit, wie z. B. Paroxetin, erzeugen Entzugssymptome mit größerer Häufigkeit[6],[15-18], schnellerem Einsetzen[6],[15-18] und größerem Schweregrad[6],[15-18] als Medikamente mit längerer Halbwertszeit, wie z. B. Fluoxetin.[6],[15],[17],[18] Paroxetin erzeugt Entzugssymptome innerhalb von 2 Tagen,[55] wohingegen die Symptome eines Fluoxetin-Entzugs um 2-6 Wochen verzögert sein können. [9],[56]
Wie beim Entzug von anderen Medikamenten steht das Auftreten dieser Entzugseffekte im Zusammenhang mit prozentualen Abnahmen der Plasmakonzentration (Konzentration des Wirkstoffes des Medikamentes im Blut, Anm. d. Ü.).[55] Höhere SSRI-Plasmaspiegel vor dem Absetzen[57] und kurz nach dem Absetzen[58] lassen verstärkte Entzugssymptome erwarten. Die Wiedereinnahme des abgesetzten SSRI lässt die Symptome im Allgemeinen innerhalb von 24 Stunden verschwinden.[3] Es wurden Ansätze erprobt, um die Entzugssymptome durch Reduzieren der SSRIs[9],[12] oder Substitution des am längsten wirkenden SSRIs, Fluoxetin,[3],[12] entsprechend den Ansätzen, die für den Entzug von anderen Wirkstoffen verwendet wurden, zu verringern. Es wird angenommen, dass individuelle Faktoren, einschließlich der Genetik,[35] eine Rolle bei der Bestimmung der Entzugseffekte spielen.
Neurobiologie des SSRI-Entzugs
Es wird angenommen, dass SSRIs ihre Wirkung durch einen zündenden Schritt bei der Hemmung des Serotonin-Transporters erzeugen, was zu einem Anstieg des Serotoninspiegels im synaptischen Spalt (dort, wo das Serotonin im Gehirn produziert wird, Anm. d. Ü.) führt und dadurch erhöhte Reaktionen an serotonergen (die Wirkung des Botenstoffes/Neurotransmitters Serotonin betreffend, Anm. d. Ü.) Rezeptoren auslöst.[59],[60] Serotonerge Neuronen modulieren auch andere Neurotransmittersysteme, einschließlich Noradrenalin, Dopamin und GABA.[47] Effekte auf die Neurogenese (Neubildung von Nervenzellen, Anm. d. Ü.), Entzündungsprozesse und die Hypothalamus-Hypophysen-Nebennieren-Achse, die den serotonergen Wirkungen nachgeschaltet sind, werden ebenfalls für die antidepressiven Wirkungen von SSRIs angenommen.[59],[61],[62]
Obwohl die Details noch nicht geklärt sind, wurde der SSRI-Entzug auf einen relativen Mangel an Serotonin im Zusammenhang mit einer weit verbreiteten Anpassung der serotonergen Rezeptoren zurückgeführt.[9],[47],[63] Es wurde gezeigt, dass eine SSRI-Behandlung die Dichte der serotonergen Rezeptoren bei Ratten herunterreguliert.[64] Auch beim Menschen wurde gezeigt, dass selbst eine kurzzeitige SSRI-Verabreichung die Empfindlichkeit des kortikalen (von der Gehirnrinde ausgehend, Anm. d. Ü.) 5-Hydroxytryptamin-Rezeptors 2A[65] und des 5-Hydroxytryptamin-Rezeptors 4 reduziert.[66] Die Umkehrung der Effekte auf Neurotransmitter, die indirekt von SSRIs beeinflusst werden, einschließlich Noradrenalin, Glutamat und GABA (unter anderem), könnte ebenfalls eine Rolle beim SSRI-Entzug spielen.[9],[47],[63] Die Rolle von Serotonin bei der Koordination von sensorischen (die Empfindung betreffend, Anm. d. Ü.) und autonomen (vom Gesamtorganismus unabhängigen, Anm. d. Ü.) Funktionen mit der motorischen (die Bewegungen betreffend, Anm. d. Ü.) Aktivität wurde in das SSRI-Absetzsyndrom einbezogen.[42] Es wird angenommen, dass eine verminderte Stimulation des 5-Hydroxytryptamin-Rezeptors 1A im Nucleus raphe, von dem bekannt ist, dass er an der Reisekrankheit beteiligt ist, mit dem Schwindel, der Übelkeit und der Antriebslosigkeit des Entzugssyndroms zusammenhängt.[47] Eine Fehlregulation der somato-sensorischen Funktionen könnte zu Parästhesien (subjektive Missempfindung wie Kribbeln, unangenehme Temperaturempfindung, taubes oder schmerzhaft brennendes Gefühl als Form der Sensibilitätsstörungen bei Erkrankungen des peripheren Nervensystems; s. Pschyrembel, Anm. d. Ü.) führen, während Bewegungsstörungen (z. B. Dystonie) auf eine veränderte dopaminerge (die Wirkung des Botenstoffes/Neurotransmitters Dopamins betreffend, Anm. d. Ü.) Funktion zurückzuführen sein könnten.[47]
Aspekte des SSRI-Absetzsyndroms könnten auch auf neuronale Veränderungen in Geweben außerhalb des Gehirns zurückgeführt werden, da serotonerge Rezeptoren an Orten wie dem Gefäßsystem und dem Darm vorhanden sind.[67]
Pharmakologische Prinzipien des Absetzens von SSRIs
Wie bei anderen Entzugssyndromen wird ein angemessenes Reduzierungsschema für SSRIs eine schrittweise Verringerung ihrer Wirkung an Serotonintransportern, ihren hauptsächlichen Anknüpfungspunkten im Rezeptoren-System, mit sich bringen.[59] PET-Studien, bei denen ein Radioligand an Serotonintransporter gebunden wurde, haben gezeigt, dass die Dosis-Wirkungs-Kurve zwischen SSRIs und Serotonintransportern der typischen hyperbolischen Beziehung entspricht, die sich als Folge des Gesetzes der Massenwirkung ergibt (Abbildung 3). Aus der Anpassungsgeraden der Dosis-Wirkungs-Kurve, die einer Michaelis-Menten-Gleichung entspricht,[68] lassen sich Werte für die prozentuale Hemmung von SERT (Serotonin-Transporter, Anm. d. Ü.) bei verschiedenen Citalopram-Dosen ableiten (Abbildung 3, Tabelle 2).[60] Bemerkenswert ist, dass die Hemmung des Serotonintransporters bei Dosen unterhalb der therapeutischen Mindestdosis für SSRIs stark abfällt.
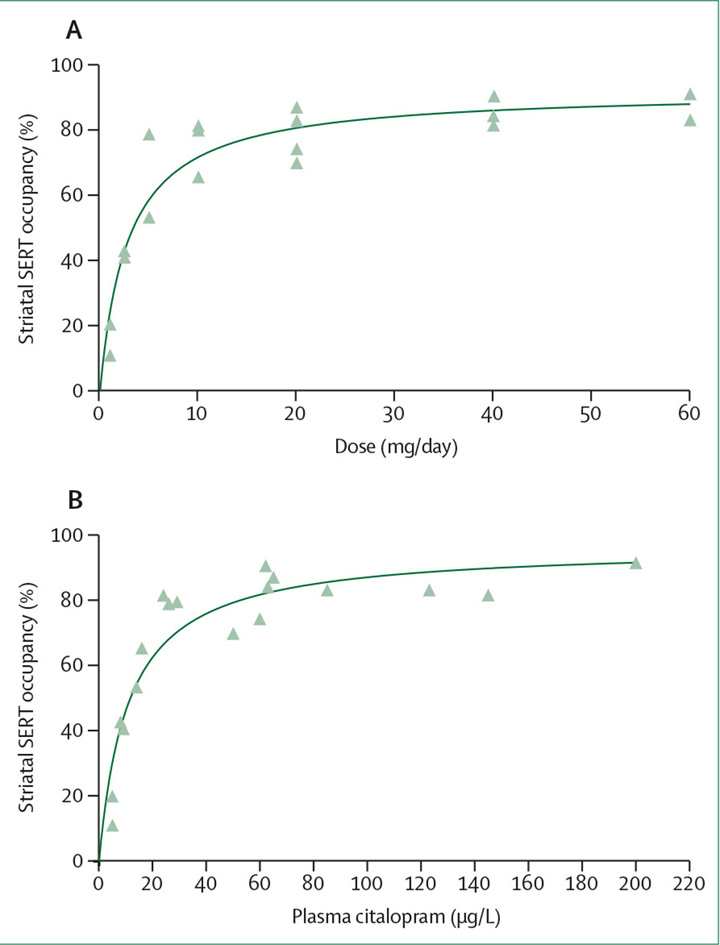
Abbildung 3: Hyperbolisches Verhältnis zwischen SERT und Dosis oder Plasmakonzentration von Citalopram.
(A) Verhältnis zwischen der Citalopram-Dosis und der SERT Belegung (%)
(B) Verhältnis zwischen dem Plasmaspiegel von Citalopram und der SERT Belegung (%)
SERT = Serotonin-Transporter. Reproduziert von Meyer und Kollegen,[60] mit Genehmigung des American Journal of Psychiatry
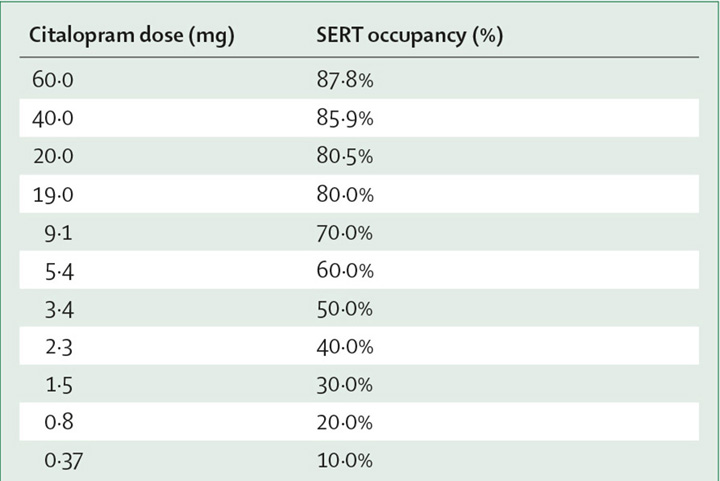
Tabelle 2: Herleitung der SERT-Belegung durch Citalopram-Dosen, berechnet nach der Michaelis-Menten-Gleichung der Enzymreaktion
Die SERT-Belegung wurde berechnet nach der Michaelis-Menten-Gleichung der Enzymreaktion, abgeleitet von Meyer et al. Gezeigt werden übliche klinische Dosen, die einer 10 % Minderung der SERT-Hemmung entsprechen. Diese Dosen können durch eine Kombination von Tabletten und Flüssigpräparaten erzielt werden. Weitere Anpassungen können notwendig sein. SERT = Serotonin-Transporter.
Es ist daher wahrscheinlich, dass Reduktionsschemata mit linearer Dosisreduktion zunehmend schwerere Entzugserscheinungen hervorrufen, da die Verringerung der Serotonin-Transporter-Hemmung zunehmend größer wird (Abbildung 4A). Beispielsweise führt eine Dosisreduktion von Citalopram in 5-mg-Schritten von 20 mg zu einer hyperbolisch zunehmenden Abnahme der Serotonin-Transporter-Hemmung: eine absolute Abnahme der Serotonin-Transporter-Hemmung von 3 % von 20 mg auf 15 mg, 6 % von 15 mg auf 10 mg, 13 % von 10 mg auf 5 mg und 58 % von 5 mg auf 0 mg. Selbst eine Reduktion von 2,5 mg (ein Viertel der kleinsten verfügbaren Tablette) auf 0,0 mg führt zu einer absoluten Reduktion der Serotonin-Transporter-Hemmung von 42,9 %, und eine Reduktion von 1,25 mg (ein Achtel einer Tablette) auf 0,00 mg führt zu einer Reduktion von 28 % (größer als die Veränderung von 40 mg auf 5 mg, die eine Reduktion von 27,3 % bewirkt). Diese große Reduktion der Hemmung könnte der Grund für den geringen Erfolg früherer Reduktionsschemata[39],[40] sein und insbesondere für die Schwierigkeiten mit Entzugssymptomen verantwortlich sein, die Patienten gegen Ende der Reduktion bei niedrigen Dosen haben.[14],[36]
Um eine lineare Reduktion der pharmakologischen Wirkung zu erreichen, ist ein hyperbolisch abfallendes Muster der Dosisreduktion erforderlich (Abbildung 4B).
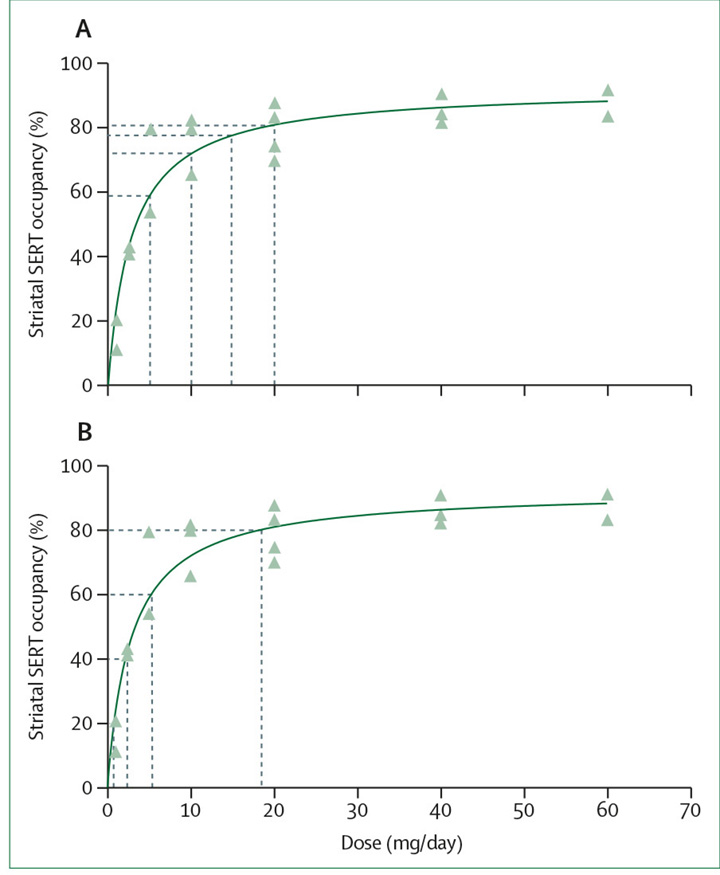
Abbildung 4: Effekte von linearer und hyperbolischer Citalopram Dosis-Reduktionen auf die Serotonin-Transporter-Belegung
(A) Lineare Dosis-Verminderungen von Citalopram (zum Beispiel Intervalle von 5 mg) rufen exponentiell wachsende Veränderungen in der SERT-Belegung hervor.
(B) Hyperbolische Dosis-Reduktionen von Citalopram erzeugen lineare Veränderungen in der SERT-Belegung (zum Beispiel Intervalle von 20 % SERT-Belegung).
SERT = Serotonin-Transporter. Reproduziert von Meyer und Kollegen,[60] mit Genehmigung des American Journal of Psychiatry
Anstatt die Dosis um feste Mengen zu verringern, sollte die Dosis entsprechend fester Abstände der biologischen Wirksamkeit gemäß verringert werden, z. B. eine 10 %-ige Verringerung der Serotonin-Transporter-Belegung (20 %-ige Verringerung ist in Abbildung 4B dargestellt). Ein Reduzierungsschema, das mit jeder Citalopram-Dosisreduktion eine etwa 10 %-ige Reduktion der Serotoninrezeptorbelegung bewirken würde, wäre: 20 mg, 9,1 mg, 5,4 mg, 3,4 mg, 2,3 mg, 1,5 mg, 0,8 mg, 0.4 mg und 0,00 mg (Tabelle 2). Weitere SSRI-Beispiele sind im Anhang (siehe ergänzender Anhang) dargestellt. Diese Schemata ermöglichen eine pharmakologisch fundierte Anwendung der oben skizzierten Entzugsprinzipien (»stop slow as you go low«).[1],[49] Das oben beschriebene Absetzschema verwendet Dosen, die denen nahekommen, die in Studien mit Absetzstreifen,[14] und in Fallstudien mit schwierigen Entzugssyndromen erfolgreich eingesetzt wurden.[36]
Einschränkungen
Es gibt potenzielle Einschränkungen bei der Auswertung der Dosis-Wirkungs-Kurve der vorgestellten PET-Studie.[60] Die Anzahl der Teilnehmer in jeder Gruppe ist relativ klein, was eventuell die Möglichkeit einschränkt, individuelle Unterschiede zu erfassen. Der Verlauf der Dosis-Wirkungs-Kurve (d. h. hyperbolisch) sollte jedoch für jedes Individuum gleich sein, was darauf hindeutet, dass hyperbolische Dosisreduktionsschemata universell anwendbar sein sollten.
SSRI können auch neurotrope (auf Nerven einwirkende, Anm. d. Ü.), entzündungshemmende und neuroendokrine (das neuroendokrine System betreffend, Anm. d. Ü.) Wirkungen haben;[61],[62] es wird jedoch angenommen, dass diese Wirkungen den Wirkungen auf die Serotonintransporter nachgeschaltet sind und zu Veränderungen im serotonergen System führen,[59],[61],[62] was darauf hinweist, dass die Belegung der Serotonintransporter wahrscheinlich ein Schlüsselindikator für die biologische Reaktion auf SSRI ist.
Es ist schwierig zu bestimmen, ob die Hemmung des Serotonin-Transporters linear mit den Entzugseffekten einhergeht. Die Serotonin-Transporter-Bindung steht im Zusammenhang mit den antidepressiven Effekten von SSRIs; es wurde gezeigt, dass sich durch das Verhältnis der Serotonin-Transporter-Bindung zwischen terminalen Regionen und dem medianen Raphe-Nucleus das Ansprechen auf die Behandlung mit SSRIs bestimmen lässt.[69] Theoretisch ist es möglich, dass ein minimaler Schwellenwert der Serotonin-Transporter-Hemmung erforderlich ist, bevor ein klinischer Effekt auftritt, wobei Werte unterhalb dieses Schwellenwerts minimale Effekte haben;[60] dies könnte auch Entzugseffekten entsprechen. Allerdings werden bei Entzugseffekten von anderen Medikamenten keine Schwelleneffekte beobachtet[45],[48] und Entzugseffekte wurden bei vielen Dosen während des Absetzens von SSRIs beobachtet,[9],[35] was darauf hindeutet, dass der Entzug wahrscheinlich einen Prozess darstellt, der eine fortgesetzte Einheit bildet. Darüber hinaus besteht eine hyperbolische Beziehung zwischen der SSRI-Dosis und der Reduktion der depressiven Stimmung, wie in einer Metaanalyse gezeigt wurde;[70] eine hyperbolische Beziehung wurde auch zwischen der SSRI-Dosis und dem Risiko von Entzugssymptomen gezeigt.[55] Diese Befunde deuten darauf hin, dass sich die hyperbolische Beziehung zwischen Dosis und Serotonin-Transporter-Hemmung auch auf die Entzugseffekte erstrecken könnte, was darauf hindeutet, dass die Serotonin-Transporter-Hemmung annähernd linear mit den Entzugseffekten in Verbindung stehen könnte.
Eine weitere mögliche Einschränkung bei der Interpretation der Dosis-Wirkungs-Kurve von Meyer und Kollegen[60] besteht darin, dass die Belegung der Serotonin-Transporter im Striatium gemessen wurde, was möglicherweise keine direkte Relevanz für die antidepressive Wirkung hat. Diese und eine spätere PET-Studie[71] zeigten jedoch, dass SSRIs eine ähnliche Hemmung der Serotonintransporter in Hirnregionen verursachen, die für die SSRI-Wirkung relevant sind (z. B. subgenuales Cingulum, Amygdala und Raphe-Kerne), mit einer ähnlichen hyperbolischen Beziehung zwischen der SSRI-Dosis und der Serotonin-Transporter-Belegung in allen untersuchten Regionen.[71]
Daher scheint es begründet zu sein zu folgern, dass SSRIs, wie die meisten pharmazeutischen Wirkstoffe, eine hyperbolische Beziehung zwischen Dosis und biologischen Effekten haben, und dass dies bei der Erstellung rationaler Absetzschemata relevant sein könnte.
Praktische Anwendung der hyperbolischen Dosisreduktion
Wahrscheinlich gibt es individuelle Unterschiede im Erleben von SSRI-Entzugseffekten.[3] Wir empfehlen, dass ein individuelles Tempo für den Entzug durch eine anfängliche versuchsweise Reduktion der SSRI-Dosis festgelegt werden kann, die einer Reduktion der Serotonin-Transporter-Belegung um 10 % (oder 5 %, wenn man vorsichtig ist) entspricht, mit anschließender Überwachung der Schwere und Dauer der Entzugssymptome. Eine anfängliche Reduktion der Serotonin-Transporter-Belegung um 10 % wird vorgeschlagen, weil dies in etwa zu einer Halbierung der Dosis gegenüber der therapeutischen Minimaldosis führen würde (z. B. von 20 mg auf 10 mg Citalopram), die von den meisten Patienten gut vertragen wird. Wenn der Wert auf der Skala der auftretenden Anzeichen und Symptome für Entzug (Checkliste Discontinuation Emergent Signs and Symptoms-DESS) des Patienten einen Monat nach der anfänglichen Reduktion wieder den Ausgangswert erreicht hat, könnte eine Absetzrate verordnet werden, die einer 10 %igen-Reduktion der Serotonin-Transporter-Belegung pro Monat entspricht. Dieser Prozess sollte laufend überwacht werden, wobei die Absetzrate entsprechend der Toleranz des Patienten angepasst werden sollte.
Das SSRI sollte so reduziert werden, dass die endgültige Reduktion auf null der zuvor vom Patienten tolerierten Reduktion entspricht (oder geringer ist). Dies sollte der Fall sein, wenn die Dosis etwa 10 % der Serotonin-Transporter-Belegung entspricht. Dabei sollte es sich um eine sehr kleine Dosis handeln – z. B. 0,4 mg für Citalopram. In Studien wurde berichtet, dass Reduktionsschemata nur dann erfolgreich waren, wenn mit ähnlich niedrigen Dosen von SSRIs gearbeitet wurde.[14],[36] Die Verwendung von SSRI in Form von Flüssigpräparaten könnte notwendig sein, um diese kleinen Dosen zu erzielen.
Es ist schwierig, den optimalen Zeitabstand zwischen den Dosisreduktionen zu bestimmen. In Ermangelung von Studien, die die Geschwindigkeit, mit der die Anpassung der Neuronen sich vollzieht, bewerten, können mehrere Punkte eine Orientierung bieten. Für alle SSRIs mit Ausnahme von Fluoxetin kann aufgrund ihrer pharmakokinetischen Eigenschaften vorausgesagt werden, dass sie zwischen 5 und 14 Tagen nach der Dosisreduktion den Steady-State (Zustand des Gleichgewichts, Anm. d. Ü.) erreichen (Tabelle 3).[72]
| Medikation | tägliche Dosis (mg) | Halbwertszeit | Zeit bis zum Erreichen des Steady State | Lineare Kinetik | Cytochrome P450 Hemmung |
|---|---|---|---|---|---|
| Fluoxetin | 20-80 | 1-4 Tage | 5-11 Wochen | Nein | 2D6 |
| Norfluoxetin | dto. | 7-15 Tage | dto. | 2D6, 3A4 | |
| Fluvoxamin | 50-300 | 15 Stunden | 10 Tage | Nein | 1A2, 2C19 |
| Paroxetin | 20-50 | 20 Stunden | 7-14 Tage | Nein | 2D6 |
| Sertralin | 50-150 | 26 Stunden | 5-7 Tage | Ja | Minimal |
| Citalopram | 10-60 | 36 Stunden | 6-10 Tage | Ja | Nicht relevant |
| Escitalopram | 5-30 | 27-33 Stunden | 7-10 Tage | Ja | 2C19, 2D6, 3A4 |
| Tabelle 3: Pharmakokinetische Eigenschaften von SSRIs und ihren klinisch aktiven Metaboliten (Adaptiert von Hiemke und Kollegen [72]) | |||||
Wie oben beschrieben, wurden Absetzsymptome bei Patienten über unterschiedliche Zeiträume festgestellt, von einigen Tagen,[9] bis hin zu Wochen und Monaten[18],[21-23],[73],[74] und, in einigen Fällen, sogar über ein Jahr[21],[22],[73],[74] hinweg. Diese Berichte stammen im Allgemeinen von Patienten, die ihre Medikation abrupt absetzten; es ist möglich, dass bei einer vorsichtigeren Reduktion die Absetzsymptome kürzer andauern. Die klinischen Wirkungen von SSRIs können sich um Wochen nach ihrem Ansetzen verzögern,[59],[70] während Nebenwirkungen innerhalb von Tagen auftreten.[75] Es ist unklar, ob die Absetzsymptome eher dem zeitlichen Muster der antidepressiven Wirkungen oder der Nebenwirkungen folgen. Es könnte hilfreich sein, Wochen nach einer SSRI-Reduktion zu warten, um verzögerte Entzugseffekte zu beobachten. Dies würde auch die Beobachtung eines Wiederauftretens der zugrunde liegenden Symptome als Folge der Verringerung der SSRI-Dosis ermöglichen. Der beste Anhaltspunkt könnte jedoch der Zeitraum sein, der erforderlich ist, bis der Score des Patienten hinsichtlich der Entzugssymptome nach einer Dosisreduktion auf den Ausgangswert zurückkehrt.
Andere Einflussfaktoren auf die Entzugssymptome von SSRIs
Andere Arzneimittel- und Patientencharakteristika beeinflussen wahrscheinlich den Schweregrad der Entzugssyndrome von SSRIs. Paroxetin und Fluoxetin werden beide durch Cytochrom P450 2D6 verstoffwechselt und hemmen ihren eigenen Metabolismus (Stoffwechsel, Anm. d. Ü.), was zu einer nicht linearen Kinetik (Pharmakokinetik, Anm. d. Ü.) führt.[76] Dies prognostiziert einen überproportionalen Abfall der Plasmakonzentrationen während des Medikamentenentzugs. Obwohl dieser Effekt bei Fluoxetin aufgrund dessen langer Halbwertszeit möglicherweise nicht klinisch bedeutsam ist, ist er bei Paroxetin wahrscheinlich bedeutsam.[47] Paroxetin könnte ein schwerwiegenderes Entzugssyndrom hervorrufen als andere SSRIs, da es eine ausgeprägte muskarin-antagonistische Wirkung aufweist [47],[63] und mäßig hemmend auf die Noradrenalin-Botenstoffe wirkt. Es ist auch wahrscheinlich, dass Patientenfaktoren wie das Vorhandensein verschiedener Cytochrom-Enzyme, die Empfindlichkeit des Serotonin-Transporters gegenüber hemmenden Faktoren und psychologische Faktoren zum Risiko von Entzugssymptomen beitragen können. Ein besseres Verständnis dieser Faktoren und die Untersuchung der Plasmaspiegel von SSRIs könnten bei der Entwicklung von personalisierten Absetzschemata hilfreich sein.
Praktische Auswirkungen der hyperbolischen Dosisreduktion
Das obige Modell löst eine von Patienten und behandelnden Ärzten häufig geäußerte Ungewissheit auf: ob eine Microtaper- oder Minitaper-Strategie (Mikroreduzieren oder Minireduzieren, Anm. d. Ü.) angewendet werden sollte. Beim Microtapering wird die SSRI-Medikation täglich oder wöchentlich in winzigen Schritten reduziert. Minitapering beinhaltet größere, schrittweise Reduzierungen mit längeren Zeitabständen zwischen den Reduzierungen (im Allgemeinen im Abstand von Wochen). Minitapering scheint sinnvoller zu sein als Microtapering. Es wird berichtet, dass Entzugssymptome bei einem großen Teil der Patienten mehrere Wochen (oder länger) nach dem Absetzen der Medikamente anhalten.[9],[13] Folglich besteht beim Microtapering die Möglichkeit, dass sich Entzugseffekte summieren und überlagern. Diese Vorgehensweise würde es erschweren, festzustellen, welche Reduzierung (oder welche Reihe von Reduzierungen) für die erlebten Symptome verantwortlich war. Es erscheint daher sinnvoll, die Dosis des Medikaments zu verringern und dann eine längere Zeitspanne verstreichen zu lassen, während der die Entzugseffekte abklingen können, bevor die nächste Reduzierung vorgenommen wird.
Fluoxetin
Die Substitution von kurz wirksamen SSRIs durch Fluoxetin wurde als Möglichkeit vorgeschlagen, um unerträgliche Entzugssymptome zu vermeiden.[3],[77] Fluoxetin verursacht nachweislich weniger schwere Entzugserscheinungen als andere SSRIs, was auf seine längere Halbwertszeit zurückgeführt wird.[3],[29],[77] Fluoxetin benötigt 35-75 Tage, um den Steady-State (Zustand des Gleichgewichts, Anm. d. Ü.) zu erreichen,[47] was wahrscheinlich der Grund dafür ist, dass Entzugssymptome bei Fluoxetin auch Wochen nach dem Absetzen beobachtet werden konnten.[9],[56] Daher wäre es ratsam, 3 Monate (35-75 Tage plus 4 Wochen) zu warten, um spät auftretende Entzugssymptome zu berücksichtigen. Angesichts dieser Eigenschaft von Fluoxetin, die einem eingebauten Reduzierungs-System ähnelt, könnte es angemessen sein, die Dosis bei jeder Wiederholung der Reduzierung um das Äquivalent von ca. 30 % der Serotonin-Transporter-Belegung zu reduzieren, gemessen an der Toleranz des Patienten.
Dennoch sollten wir bei der Annahme vorsichtig sein, dass Fluoxetin einen Selbstreduzierungs-Mechanismus besitzt und daher abrupt oder schnell abgesetzt werden kann, wie es die Leitlinien empfehlen.[29],[78] Obwohl das pharmakokinetische Profil von Fluoxetin eine allmähliche Abnahme des Plasmaspiegels erwarten lässt, könnte eine kurze Reduktion (z. B. 2 Wochen)[27] immer noch ein schnelles Absetzschema darstellen, das eine 10 %-ige Abnahme der biologischen Wirkung pro Monat übersteigt.
Zukünftige Ausrichtung der Forschung
Wir haben hier eine pharmakologisch fundierte Methode für das Absetzen von SSRI-Behandlungen empfohlen, deren Gültigkeit durch randomisierte kontrollierte Studien evaluiert werden sollte. Durch Skalen beschriebene Absetzprogramme, die die Variationen des Ansprechens auf das Absetzen in bildlichen Werten darstellen, könnten als Richtschnur für die Absetzschritte dienen (Abbildung 5).

Abbildung 5: Hypothetisches Diagramm, um Entzugsschritte für Citalopram zu bestimmen
Ein beispielhaftes Absetzschema von 20 mg Citalopram wird hier beschrieben (Dosis-Achse ist logorithmisch skaliert). Das Ziel der Patientin folgt ursprünglich der Verlaufsbahn einer 50 %-Dosisreduktion, was Dosis-Reduktionen von einer 10 %-Serotonin-Transporterbelegung alle 4 Wochen entspricht (20 mg, 9,1 mg und 5,4 mg). Die Patientin erlebt daraufhin unangenehme Nebenwirkungen (zum Beispiel einen Wert von 3 auf der Skala der “auftretenden Zeichen und Symptome von Entzug“). Als sie ihr Entzugsschema hin zu der langsameren Variante von 70 % verschiebt, erfährt sie als Ergebnis keine unerträglichen Entzugssymptome mehr, bis sie den Entzug beendet.
Risikofaktoren, wie z. B. der SSRI-Plasmaspiegel, der Cytochrom-Enzym-Status, die PET-Messung der Serotonin-Transporter-Belegung und andere genetische, metabolische und psychologische Faktoren könnten in diese Skalen aufgenommen werden, sobald ihre Auswirkungen geklärt sind. Pharmakologische und nicht-pharmakologische Mittel zur Verbesserung der Verträglichkeit des SSRI-Entzugs sind ebenfalls zu erforschen. Psychologische Behandlungsmethoden, wie die vorbeugende kognitive Therapie und andere CBT-Verfahren (kognitiv basierte Therapien, Anm. d. Ü.), haben sich als geeignet erwiesen, das Rückfallrisiko bei Patienten mit wiederkehrenden Depressionen und bei denjenigen, die ihre Antidepressiva absetzen, zu reduzieren.[39],[40]
Wir empfehlen, dass das hier beschriebene Absetzschema für die klinische Praxis in Erwägung gezogen werden sollte, solange es keine besseren wissenschaftlichen Ergebnisse gibt, um das Absetzen anzuleiten. Es ergeben sich nur wenige Nachteile, wenn man einen langsameren Absetzprozess empfiehlt.[29] Zumindest sollte man sich darüber im Klaren sein, dass Absetzphasen von 2 bis 4 Wochen bei vielen Patienten wahrscheinlich nicht ausreichen, um die Entzugssymptome zu reduzieren, wobei längere Absetzphasen und Schemata, die eine niedrigere Medikamentendosis beinhalten, vermutlich effektiver sind. Weitere empirische Studien zu Absetzschemata, einschließlich des hier vorgeschlagenen, sind dringend erforderlich, was als Konsequenz die Aktualisierung der formalen Richtlinien beinhalten sollte.
Mitwirkende:
MAH konzipierte die Manuskriptidee, schrieb das Manuskript und zeichnete die Abbildungen. DT half, die Idee zu entwickeln, und überarbeitete und redigierte das Manuskript.
Fußnoten
Quelle:[1] Bain KT, Holmes HM, Beers MH, Maio V, Handler SM, Pauker SG. Discontinuing medications: a novel approach for revising the prescribing stage of the medicationuse process. J Am Geriatr Soc 2008; 56: 1946–52.
[2] Howland RH. Potential adverse effects of discontinuing psychotropic drugs: part 2: antidepressant drugs. J Psychosoc Nurs Ment Health Serv 2010; 48: 9–12.
[3] Haddad PM, Anderson IM. Recognising and managing antidepressant discontinuation symptoms. Adv Psychiatr Treat 2007; 13: 447–57.
[4] Schatzberg AF, Haddad P, Kaplan EM, et al. Serotonin reuptake inhibitor discontinuation syndrome: a hypothetical definition. Discontinuation Consensus panel. J Clin Psychiatry 1997; 58 (suppl 7): 5–10.
[5] American Psychiatric Association. The diagnostic and statistical manual of mental disorders, 5th edn. Arlington, VA: American Psychiatric Publishing, 2013.
[6] Rosenbaum JF, Fava M, Hoog SL, Ascroft RC, Krebs WB. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998; 44: 77–87.
[7] Warner CH, Bobo W, Warner C, Reid S, Rachal J. Antidepressant discontinuation syndrome. Am Fam Physician 2006; 74: 449–56.
[8] Shelton RC. Steps following attainment of remission: discontinuation of antidepressant therapy. Prim Care Companion J Clin Psychiatry 2001; 3: 168–74.
[9] Fava GA, Gatti A, Belaise C, Guidi J, Offidani E. Withdrawal symptoms after selective serotonin reuptake inhibitor discontinuation: a systematic review. Psychother Psychosom 2015; 84:
72–81.
[10] Black K, Shea C, Dursun S, Kutcher S. Selective serotonin reuptake inhibitor discontinuation syndrome: proposed diagnostic criteria. J Psychiatry Neurosci 2000; 25: 255–61.
[11] Young A, Haddad P. Discontinuation symptoms and psychotropic drugs. Lancet 2000; 355: 1184.
[12] Cleare A, Pariante CM, Young AH, et al. Evidencebased guidelines for treating depressive disorders with antidepressants: a revision of the 2008 British Association for
Psychopharmacology guidelines. J Psychopharmacol 2015; 29: 459–525.
[13] Davies J, Read J. A systematic review into the incidence, severity and duration of antidepressant withdrawal effects: are guidelines evidencebased? Addict Behav 2018; published online Sept 4. DOI:10.1016/j.addbeh.2018.08.027 (preprint).
[14] Groot PC, van Os J. Antidepressant tapering strips to help people come off medication more safely. Psychosis 2018; 10: 142–45.
[15] Bogetto F, Bellino S, Revello RB, Patria L. Discontinuation syndrome in dysthymic patients treated with selective serotonin reuptake inhibitors: a clinical investigation. CNS Drugs
2002; 16: 273–83.
[16] Tint A, Haddad PM, Anderson IM. The effect of rate of antidepressant tapering on the incidence of discontinuation symptoms: a randomised study. J Psychopharmacol 2008; 22: 330–32.
[17] Hindmarch I, Kimber S, Cockle SM. Abrupt and brief discontinuation of antidepressant treatment: effects on cognitive function and psychomotor performance. Int Clin Psychopharmacol
2000; 15: 305–18.
[18] Royal College of Psychiatrists. Coming off antidepressants. 2012. www.rcpsych.ac.uk/healthadvice/treatmentswellbeing/anti depressants/comingoffantidepressants.aspx (accessed March
12018).
[19] Bosman RC, Huijbregts KM, Verhaak PF, et al. Longterm antidepressant use: a qualitative study on perspectives of patients and GPs in primary care. Br J Gen Pract 2016; 66: e708–19.
[20] Valuck RJ, Orton HD, Libby AM. Antidepressant discontinuation and risk of suicide attempt. J Clin Psychiatry 2009; 70: 1069–77.
[21] Davies J, Regina P, Montagu L. Antidepressant withdrawal: a survey of patients’ experience by the AllParty Parliamentary Group for Prescribed Drug Dependence. 2018.
https://prescribeddrug.org/wpcontent/uploads/2018/10/APPGPDDSurveyofantidepressantwithdrawalexperiences.pdf (accessed Nov 1, 2018).
[22] Fava GA, Bernardi M, Tomba E, Rafanelli C. Effects of gradual discontinuation of selective serotonin reuptake inhibitors in panic disorder with agoraphobia. Int J Neuropsychopharmacol 2007; 10: 835–38.
[23] Bhanji NH, Chouinard G, Kolivakis T, Margolese HC. Persistent tardive rebound panic disorder, rebound anxiety and insomnia following paroxetine withdrawal: a review of reboundwithdrawal phenomena. Can J Clin Pharmacol 2006; 13: e69–74.
[24] Johnson CF, Macdonald HJ, Atkinson P, Buchanan AI, Downes N, Dougall N. Reviewing longterm antidepressants can reduce drug burden: a prospective observational cohort study. Br J Gen Pract 2012; 62: 773–79.
[25] Eveleigh R, Muskens E, Lucassen P, et al. Withdrawal of unnecessary antidepressant medication: a randomised controlled trial in primary care. BJGP Open 2017; 34: bjgpopen17X101265.
[26] NICE. Depression in adults: recognition and management (CG90). London: National Institute for Health and Care Excellence, 2009.
[27] MIMS. Antidepressants, a guide to switching and withdrawing. https://www.mims.co.uk/Tables/882430/SwitchingAntidepressants/ (accessed Nov 1, 2018).
[28] Hirsch M, Birnbaum RJ. Antidepressant medication in adults: switching and discontinuing medication. https://www.uptodate. com/contents/discontinuingantidepressantmedicationsinadults (accessed Feb 11, 2019).
[29] Ogle NR, Akkerman SR. Guidance for the discontinuation or switching of antidepressant therapies in adults. J Pharm Pract 2013; 26: 389–96.
[30] Baldwin DS, Cooper JA, Huusom AKT, Hindmarch I. A doubleblind, randomized, parallelgroup, flexibledose study to evaluate the tolerability, efficacy and effects of treatment discontinuation with escitalopram and paroxetine in patients with major depressive disorder. Int Clin Psychopharmacol 2006; 21: 159–69.
[31] Montgomery SA, Kennedy SH, Burrows GD, Lejoyeux M, Hindmarch I. Absence of discontinuation symptoms with agomelatine and occurrence of discontinuation symptoms with paroxetine: a randomized, doubleblind, placebocontrolled discontinuation study. Int Clin Psychopharmacol 2004; 19: 271–80.
[32] Phelps J. Tapering antidepressants: is 3 months slow enough? Med Hypotheses 2011; 77: 1006–08.
[33] Himei A, Okamura T. Discontinuation syndrome associated with paroxetine in depressed patients: a retrospective analysis of factors involved in the occurrence of the syndrome. CNS Drugs 2006; 20: 665–72.
[34] van Geffen EC, Hugtenburg JG, Heerdink ER, van Hulten RP, Egberts AC. Discontinuation symptoms in users of selective serotonin reuptake inhibitors in clinical practice: tapering versus abrupt discontinuation. Eur J Clin Pharmacol 2005; 61: 303–07.
[35] Murata Y, Kobayashi D, Imuta N, et al. Effects of the serotonin 1A, 2A, 2C, 3A, and 3B and serotonin transporter gene polymorphisms on the occurrence of paroxetine discontinuation syndrome. J Clin Psychopharmacol 2010; 30: 11–17.
[36] Amsden GW, Georgian F. Orthostatic hypotension induced by sertraline withdrawal. Pharmacotherapy 1996; 16: 684–86.
[37] Dominguez RA, Goodnick PJ. Adverse events after the abrupt discontinuation of paroxetine. Pharmacotherapy 1995; 15: 778–80.
[38] Benazzi F. Venlafaxine withdrawal symptoms. Can J Psychiatry 1996; 41: 487.
[39] Bockting CLH, Klein NS, Elgersma HJ, et al. Effectiveness of preventive cognitive therapy while tapering antidepressants versus maintenance antidepressant treatment versus their combination in prevention of depressive relapse or recurrence (DRD study): a threegroup, multicentre, randomised controlled trial. Lancet Psychiatry 2018; 5: 401–10.
[40] Scholten WD, Batelaan NM, van Oppen P, et al. The efficacy of a group CBT relapse prevention program for remitted anxiety disorder patients who discontinue antidepressant medication: a randomized controlled trial. Psychother Psychosom 2018; 87: 240–42.
[41] Baldessarini RJ, Tondo L, Ghiani C, Lepri B. Illness risk following rapid versus gradual discontinuation of antidepressants. Am J Psychiatry 2010; 167: 934–41.
[42] Maixner SM, Greden JF. Extended antidepressant maintenance and discontinuation syndromes. Depress Anxiety 1998; 8 (suppl 1): 43–53.
[43] Turton S, LingfordHughes A. Neurobiology and principles of addiction and tolerance. Medicine (Baltimore) 2016; 44: 693–96.
[44] Dilsaver SC. Withdrawal phenomena associated with antidepressant and antipsychotic agents. Drug Saf 1994; 10: 103–14.
[45] Ashton H. The diagnosis and management of benzodiazepine dependence. Curr Opin Psychiatry 2005; 18: 249–55.
[46] Hodding GC, Jann M, Ackerman IP. Drug withdrawal syndromes: a literature review. West J Med 1980; 133: 383–91.
[47] Olver JS, Burrows GD, Norman TR. Discontinuation syndromes with selective serotonin reuptake inhibitors: are there clinically relevant differences? CNS Drugs 1999; 12: 171–77.
[48] Lader M, Tylee A, Donoghue J. Withdrawing benzodiazepines in primary care. CNS Drugs 2009; 23: 19–34.
[49] Brett J, Murnion B. Management of benzodiazepine misuse and dependence. Aust Prescr 2015; 38: 152–55.
[50] Chou TC, Talalay P. Quantitative analysis of doseeffect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regul 1984; 22: 27–55.
[51] Brouillet E, Chavoix C, Bottlaender M, et al. In vivo bidirectional modulatory effect of benzodiazepine receptor ligands on GABAergic transmission evaluated by positron emission tomography in nonhuman primates. Brain Res 1991; 557: 167–76.
[52] Ashton H. The treatment of benzodiazepine dependence. Addiction 1994; 89: 1535–41.
[53] Weller IVD, Ashby D, Brook R, et al. Report of the CSM Expert Working Group on the safety of selective serotonin reuptake inhibitors. London: Medicines and Healthcare Products Regulatory Agency, 2005.
[54] Perahia DG, Kajdasz DK, Desaiah D, Haddad PM. Symptoms following abrupt discontinuation of duloxetine treatment in patients with major depressive disorder. J Affect Disord 2005; 89: 207–12.
[55] Michelson D, Fava M, Amsterdam J, et al. Interruption of selective serotonin reuptake inhibitor treatment. Doubleblind, placebocontrolled trial. Br J Psychiatry 2000; 176: 363–68.
[56] Zajecka J, Fawcett J, Amsterdam J, et al. Safety of abrupt discontinuation of fluoxetine: a randomized, placebocontrolled study. J Clin Psychopharmacol 1998; 18: 193–97.
[57] Henry ME, Moore CM, Kaufman MJ, et al. Brain kinetics of paroxetine and fluoxetine on the third day of placebo substitution: a fluorine MRS study. Am J Psychiatry 2000; 157: 1506–08.
[58] YasuiFurukori N, Hashimoto K, Tsuchimine S, Tomita T. Characteristics of escitalopram discontinuation syndrome: a preliminary study. Clin Neuropharmacol 2016; 39: 125–27.
[59] Stahl SM. Mechanism of action of serotonin selective reuptake inhibitors. Serotonin receptors and pathways mediate therapeutic effects and side effects. J Affect Disord 1998; 51: 215–35.
[60] Meyer JH, Wilson AA, Sagrati S, et al. Serotonin transporter occupancy of five selective serotonin reuptake inhibitors at different doses: an [11C]DASB positron emission tomography study. Am J Psychiatry 2004; 161: 826–35.
[61] Malberg JE, Schechter LE. Increasing hippocampal neurogenesis: a novel mechanism for antidepressant drugs. Curr Pharm Des 2005; 11: 145–55.
[62] Janssen DG, Caniato RN, Verster JC, Baune BT. A psychoneuroimmunological review on cytokines involved in antidepressant treatment response. Hum Psychopharmacol 2010; 25: 201–15.
[63] Renoir T. Selective serotonin reuptake inhibitor antidepressant treatment discontinuation syndrome: a review of the clinical evidence and the possible mechanisms involved. Front Pharmacol 2013; 4: 45.
[64] Wamsley JK, Byerley WF, McCabe RT, McConnell EJ, Dawson TM, Grosser BI. Receptor alterations associated with serotonergic agents: an autoradiographic analysis. J Clin Psychiatry 1987; 48 (suppl): 19–25.
[65] Meyer J, Kapur S, Eisfeld B, et al. The effect of paroxetine on 5HT(2A) receptors in depression: an [(18)F]setoperone PET imaging study. Am J Psychiatry 2001; 158: 78–85.
[66] Haahr ME, Fisher PM, Jensen CG, et al. Central 5HT4 receptor binding as biomarker of serotonergic tonus in humans: a [11C]SB207145 PET study. Mol Psychiatry 2014; 19: 427–32.
[67] Mawe GM, Hoffman JM. Serotonin signalling in the gut: functions, dysfunctions and therapeutic targets. Nat Rev Gastroenterol Hepatol 2013; 10: 473–86.
[68] Atkins GL, Nimmo IA. A comparison of seven methods for fitting the MichaelisMenten equation. Biochem J 1975; 149: 775–77.
[69] Lanzenberger R, Kranz GS, Haeusler D, et al. Prediction of SSRI treatment response in major depression based on serotonin transporter interplay between median raphe nucleus and projection areas. Neuroimage 2012; 63: 874–81.
[70] Hieronymus F, Nilsson S, Eriksson E. A megaanalysis of fixeddose trials reveals dosedependency and a rapid onset of action for the antidepressant effect of three selective serotonin reuptake inhibitors. Transl Psychiatry 2016; 6: e834.
[71] Baldinger P, Kranz GS, Haeusler D, et al. Regional differences in SERT occupancy after acute and prolonged SSRI intake investigated by brain PET. Neuroimage 2014; 88: 252–62.
[72] Hiemke C, Härtter S. Pharmacokinetics of selective serotonin reuptake inhibitors. Pharmacol Ther 2000; 85: 11–28.
[73] Stockmann T, Odegbaro D, Timimi S, Moncrieff J. SSRI and SNRI withdrawal symptoms reported on an internet forum. Int J Risk Saf Med 2018; 29: 175–80.
[74] Belaise C, Gatti A, Chouinard VA, Chouinard G. Patient online report of selective serotonin reuptake inhibitorinduced persistent postwithdrawal anxiety and mood disorders. Psychother Psychosom 2012; 81: 386–88.
[75] Ferguson JM. SSRI antidepressant medications: adverse effects and tolerability. Prim Care Companion J Clin Psychiatry 2001; 3: 22–27.
[76] Preskorn SH. Clinically relevant pharmacology of selective serotonin reuptake inhibitors. An overview with emphasis on pharmacokinetics and effects on oxidative drug metabolism. Clin Pharmacokinet 1997; 32 (suppl 1): 1–21.
[77] Schatzberg AF, Blier P, Delgado PL, Fava M, Haddad PM, Shelton RC. Antidepressant discontinuation syndrome: consensus panel recommendations for clinical management and additional research. J Clin Psychiatry 2006; 67 (suppl 4): 27–30.
[78] Perahia DG, Quail D, Desaiah D, Corruble E, Fava M. Switching to duloxetine from selective serotonin reuptake inhibitor antidepressants: a multicenter trial comparing 2 switching techniques. J Clin Psychiatry 2008; 69: 95–105.
